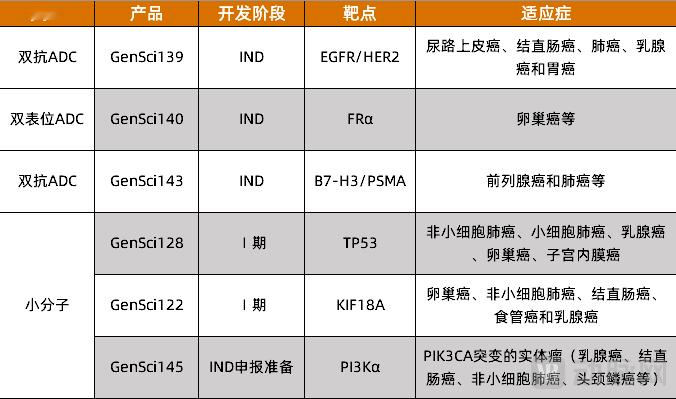
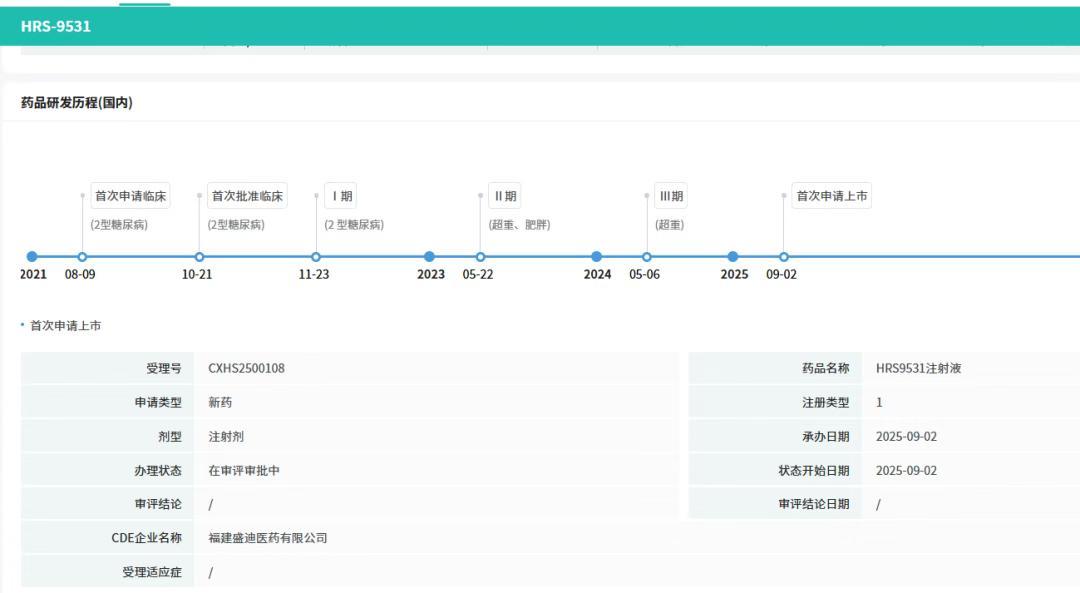
9月1日,恒瑞医$LLY(LLY)药发布公告,称其子公司福建盛迪医药有限公司自主研发的GLP-1R/GIPR双靶点激动剂HRS9531的药品上市申请,已获国家药监局受理。目前,全球范围内获批上市的GLP-1/GIP双受体激动剂仅有礼来的替尔泊肽,恒瑞医药凭借HRS9531III期临床的全面成功,正式向这一市场霸主发起挑战。

HRS9531此次提交上市申请,拟定适应症为在控制饮食和增加运动基础上,初始体重指数(BMI)符合特定要求的成人的长期体重管理,即BMI≥28kg/m²(肥胖),或≥24kg/m²(超重)并伴有至少一种体重相关合并症(例如高血糖、高血压、血脂异常、阻塞性睡眠呼吸暂停、脂肪肝等)。
从作用机制来看,HRS9531通过同时激活GLP-1和GIP受体信号通路发挥降糖减重作用。GIP参与胰岛素分泌,并在中枢神经系统中调节能量平衡,有助于促进热量消耗;GLP-1则抑制胃排空、增强饱腹感,同时促进胰岛素分泌和降低胰高血糖素水平。这种“协同增效”机制,使HRS9531在减重效果上潜力巨大,被业内认为是恒瑞医药在研管线中“最重磅品种”之一。
一、恒瑞医药国内外齐布局,国内药企鏖战正酣
恒瑞医药的HRS9531是目前进展最快的GLP-1/GIP双靶点减重药之一,目前已在中国提交上市申请,成为国内首个申报上市的同类产品。Ⅲ期临床显示,各剂量组(2mg、4mg、6mg)在主要及关键次要终点均优于安慰剂,6mg组平均减重19.2%,44.4%受试者减重≥20%。Ⅱ期临床中,8mg组治疗36周平均减重22.8%,具与替尔泊肽抗衡的潜力。
恒瑞早已布局HRS9531的海外市场。2024年5月,将GLP-1产品组合以1亿美元首付款、1000万美元近期里程碑付款、累计不超过59.25亿美元的里程碑付款以及19.9%股权的价格,授权给了KaileraTherapeutics(Hercules)。这一交易不仅带动了国内Newco模式,也为HRS9531的全球商业化奠定了基础。在国内,HRS9531是国内首个提交上市申请的原研GLP-1/GIP双靶点激动剂,进度处于绝对领先地位。其III期数据(19.2%的减重幅度)已初步展现出与替尔泊肽(SURMOUNT-1研究中15mg剂量组减重20.9%)同等级别的强大疗效潜力,未来上市后,将形成“进口原研”与“国产创新”双雄并立的竞争局面。
司美格鲁肽原研产品在国内的化合物专利将于2026年到期,这吸引了众多国内药企布局相关领域。除了恒瑞医药,2025年6月底,信达生物GCG/GLP-1双受体激动剂玛仕度肽获批上市。此外,康缘、东阳光、华东医药等10数款GLP-1多靶点药物临床研究正在进行中,国内减重市场竞争序幕已经悄然升级。
二、超40亿元销售,集采与价格战隐忧浮现
司美格鲁肽成为2025年上半年全球药品销售冠军,GLP-1药物的风潮还在延续。据摩熵医药数据库显示,司美格鲁肽相关品种在2024年全终端医院销售总额超40亿元。
目前,国内惠升生物、成都倍特、石药集团欧意药业、杭州中美华东、珠海联邦、齐鲁制药、丽珠集团、九源基因等企业提交了司美格鲁肽的上市申请;处于II/III期临床试验阶段的国产司美格鲁肽至少还有10款以上。
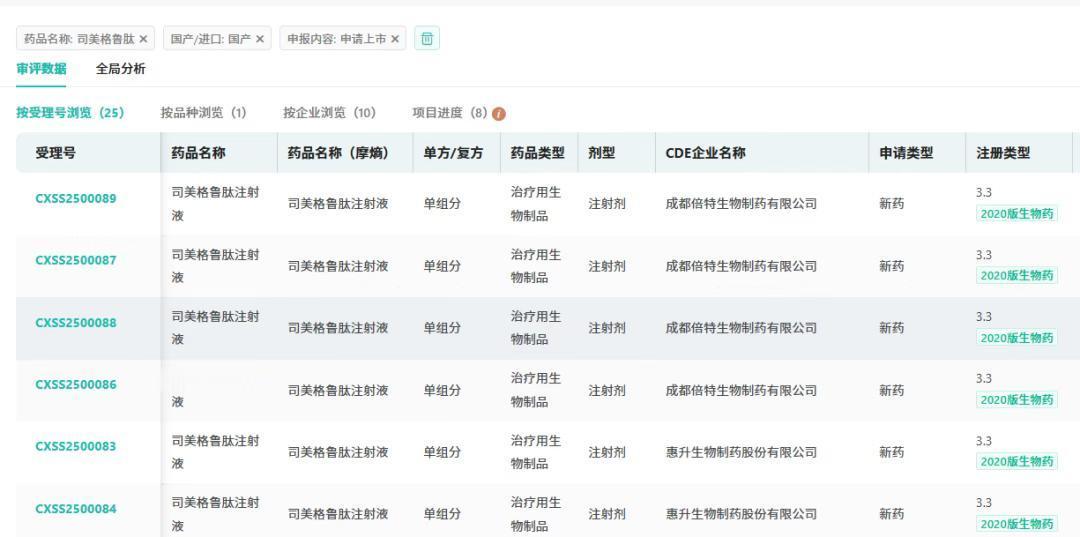
预计近1到2年内,大批GLP-1产品陆续上市,不仅会引发价格战,更会重塑整个市场格局。海通证券认为,2026年国产司美格鲁肽将进入“混战期”,最快到明年,中国市场上可能就有五、六款司美格鲁肽的生物类似药和原研药展开厮杀。很快,司美格鲁肽就将符合国家药品带量集采的要求,药价势必走低,这将更考验各家公司的产能和商业化能力。
小结
恒瑞医药的HRS9531注射液上市申请获受理,是中国创新药在GLP-1赛道的重磅发声。它不局限于“me-too”或“me-better”,而是国产药企向全球第一梯队的强力冲击,为超重/肥胖患者提供高效、更具可及性的国产创新疗法。
未来,HRS9531获批上市后,将惠及众多中国患者、减轻社会疾病负担,更会提升中国制药工业在全球创新格局中的地位。国产创新正强势开启中国减重治疗“双靶点”时代,且看医药巅峰对决如何重塑新格局。